تومورهای تالاموسی
خلاصه مقاله
تومورهای تالاموس نادر هستند و تقریباً 5 درصد از کل تومورهای مغزی را تشکیل می دهند. در همه گروه های سنی رخ می دهد اما در کودکان شایع تر است. پیشرفتها در روشهای تصویربرداری و تکنیکهای میکروسرجری، رویکردهای هدفمند جمجمهای را ایجاد کرده است که عوارض جراحی را به حداقل میرساند و میزان ایمن برداشتن ضایعه را به حداکثر میرساند. با ادامه پیشرفت تکنیکهای جراحی میکروسکوپی، رویکردهای جراحی مؤثرتری برای تومورهای تالاموس قابل دستیابی است. علائم و نشانهها مربوط به افزایش فشار داخل جمجمه (به عنوان مثال، سردرد پیشانی، بی حالی و استفراغ) و علائم ادم پاپی می شود. قسمت داخلی هر تالاموس مرزهای جانبی بطن سوم را تشکیل می دهد. اختلال در هسته های خاص (specific nuclei) می تواند یافته های ویژهای را استخراج کند: هسته های Reticular و intralaminar - هسته های حسی - هسته های Effector - هسته های Associative - هسته لیمبیک. MRI با کنتراست، روش تشخیصی اصلی برای این تومورها است. توالی بازیابی وارونگی ضعیف شده با مایع (FLAIR) می تواند برای تومورهایی که با کنتراست تقویت نمی شوند مفید باشد. تصویربرداری (DTI) می تواند به ایجاد رابطه بین مسیر قشر نخاعی و تومورهای تالاموس، به ویژه نوع thalamopeduncular کمک کند. تومورهای اولیه تالاموس منشأ گلیالی دارند. شیمیدرمانی. برخی از جراحان بسته به تشخیص، روش stereotactic needle biopsy و درمان کمکی (adjuvant) را دنبال میکنند (2). هیدروسفالی علامت دار اغلب به مداخله جراحی برای قرار دادن شانت ventriculoperitoneal یا جراحی debulking نیاز دارد تا بتواند دینامیک مایع مغزی نخاعی native (CSF) را فعال کند. انتخاب روش مناسب به منشاء، الگوی رشد تومور در رابطه با ساختارهای طبیعی و پاتولوژی مشکوک بستگی دارد. سطح راحتی و تجربه جراح با رویکرد انتخابی نیز عامل مهمی است. روشهای جراحی متعددی، از جمله روشهای anterior interhemispheric transcallosal، transcortical transventricular، contralateral infratentorial supracerebellar، posterior interhemispheric parasplenial و transsylvian transinsular توصیف شدهاند. آناتومی ورید و تغییرات آن در اطراف superior parietal lobule باید قبل از جراحی برای مسیرهای بین نیمکره ای مورد توجه قرار گیرد. 6 ناحیه تشریحی تالاموس : منطقه 1: تومورهای تالاموس قدامی تحتانی (رویکرد زیر پیشانی سوپراکاروتید اوربیتوزیگوماتیک) روش Transrostral/Subfrontal Translamina Terminalis Approach :این رویکرد محدود به تومورهای نسبتاً کوچک تالاموس قدامی تحتانی است. رزکسیون کلی تومورهای بزرگ معمولاً مشکل ساز است و بدون عقب نشینی غیرمجاز (undue retraction) در ساختارهای عصبی عروقی طبیعی اطراف امکان پذیر نیست. این رویکرد مناسب نیست و مسیر orbitozygomatic را که در بالا مورد بحث قرار گرفت، رویکرد بهتری است. منطقه 2: تومورهای تالاموس داخلی رویکرد( Anterior Interhemispheric Transcallosal ) :مرکز تومور در ناحیه تالاموس قدامی و میانی قرار دارد و به سطح pial دیواره بطن سوم می رسد روش Suprapineal Recess/Supracerebellar Transventricular: از معایب این روش می توان به آسیب پذیری habenula، رگ Galen و quadrigeminal plate اشاره کرد. منطقه 3: تومورهای تالاموس جانبی روش (Contralateral Anterior Interhemispheric Transcallosal Approach) نتیجه از رویکرد طرف مقابل (contralateral approach)، از طریق این اپروچ یک مسیر عرضی جانبی امکان پذیر (more feasible lateral cross-court trajectory) به سمت تالاموس جانبی به دست می آید. در هنگام برداشتن ضایعات تالاموس جانبی به دلیل مجاورت نزدیک کپسول داخلی باید احتیاط کرد.
مقدمه
تومورهای تالاموس نادر هستند و تقریباً 5 درصد از کل تومورهای مغزی را تشکیل می دهند(1). در همه گروه های سنی رخ می دهد اما در کودکان شایع تر است. در گذشته، با توجه به ماهیت عمیق تومورهای تالاموس و ماهیت بسیار آشکار (eloquent) هستهها و فاسیکولهای تالاموس، خطر برداشتن آنها بالا بود.
با این حال، پیشرفتها در روشهای تصویربرداری و تکنیکهای میکروسرجری، رویکردهای هدفمند جمجمهای را ایجاد کرده است که عوارض جراحی را به حداقل میرساند و میزان ایمن برداشتن ضایعه را به حداکثر میرساند. بنابراین، با ادامه پیشرفت تکنیکهای جراحی میکروسکوپی، رویکردهای جراحی مؤثرتری برای تومورهای تالاموس قابل دستیابی است(2).
تظاهرات بالینی
تومورهای تالاموس به دلیل اختلال در راه و ادغام سیگنالهای حرکتی، حسی و تنظیمی، پتانسیل ایجاد نقصهای عمیق (profound deficits) را دارند. علائم و نشانهها عموماً به اثر تودهای یا اختلالات هستههای گسسته تالاموس (discrete thalamic nuclei) مربوط میشوند. مورد اول شایع ترین عامل است که منجر به علائم مربوط به افزایش فشار داخل جمجمه (به عنوان مثال، سردرد پیشانی، بی حالی و استفراغ) و علائم ادم پاپی می شود.
قسمت داخلی هر تالاموس مرزهای جانبی بطن سوم را تشکیل می دهد. بیرون زدگی از طریق اثر توده تومور می تواند باعث هیدروسفالی غیر ارتباطی شود. اختلال در هسته های خاص (specific nuclei) می تواند یافته های ویژهای را استخراج کند. در زیر تقسیم بندی های خاص و اهمیت عملکردی آنها آمده است:
- هسته های Reticular و intralaminar : مرتبط با برانگیختگی و تنظیم درد
- هسته های حسی: همه حوزه های حسی به جز بویایی را تنظیم می کند
- هسته های Effector: عملکرد زبان حرکتی (motor language) را کنترل می کنند
- هسته های Associative : کارکردهای شناختی را نشان می دهد
- هسته لیمبیک: خلق و خو و انگیزه را در بر می گیرد
به عنوان مثال، تهاجم به هسته قدامی و بطنی جانبی می تواند منجر به نقص حرکتی و هماهنگی به دلیل برآمدگی و فشار به مخچه، عقده های قاعده ای و قشر حرکتی تکمیلی (supplementary motor cortex) شود. اختلال در برآمدگی در هسته های ventroposterolateral و ventroposteromedial می تواند به ترتیب بر رله somatosensory بدن و صورت تأثیر بگذارد. درگیری هسته های pulvinar می تواند از طریق ارتباط تغییر یافته با قشر بینایی باعث تغییر در توجه بصری (visual attention) شود، در حالی که درگیری هسته midline و intralaminar می تواند برانگیختگی ناشی از ارتباط با هیپوکامپ و تشکیل شبکه (reticular formation) را تغییر دهد (2).
ارزیابی
MRI با کنتراست، روش تشخیصی اصلی برای این تومورها است. استفاده از ماده حاجب به تشخیص تومور از بافت طبیعی کمک می کند. برای تومورهای گلیال، کنتراست همچنین نشان دهنده درجه هیستوپاتولوژیک است. مهم است که آناتومی عروق را از MRI با وزن T2 جمع آوری کنید و به تخلیه وریدی عمقی توجه کنید زیرا در رویکردهای خلفی اهمیت ویژه ای دارد.
توالی بازیابی وارونگی ضعیف شده با مایع (The fluid-attenuated inversion recovery) (FLAIR) می تواند برای تومورهایی که با کنتراست تقویت نمی شوند مفید باشد. تمرکز خاصی باید بر روی سیستم بطنی برای ارزیابی هیدروسفالی باشد. تصویربرداری Diffusion tensor (DTI) می تواند به ایجاد رابطه بین مسیر قشر نخاعی و تومورهای تالاموس، به ویژه نوع thalamopeduncular کمک کند. در این موارد، تصویربرداری DTI قبل از عمل برای انتخاب مسیر ایمن برای حذف تومور حیاتی است.
پاتولوژی
اکثریت قریب به اتفاق تومورهای اولیه تالاموس منشأ گلیالی دارند(3). در بزرگسالان، تومورهای آستروسیتی با درجه بالا، 40 درصد از گلیوماهای تالاموس را تشکیل می دهند. آستروسیتوم های آناپلاستیک و گلیوبلاستوما به ترتیب تقریباً 17% و 23% از این تومورهای درجه بالا را تشکیل می دهند. کمتر از 20 درصد از تمام تومورهای اولیه تالاموس germinoma، ganglioglioma، oligodendroglioma، dysembryoplastic neuroepithelial tumor یا neurocytoma است(2).
تومورهای تالاموس اغلب ماهیتی گلیال دارند و نشان داده شده است که حاوی جهش p53، O-6-methylguanine-DNA methyltransferase (MGMT)، phosphatase and tensin homolog (PTEN)، گیرنده epidermal growth factor (EGFR) و oligodendrocyte lineage transcription factor 2 (Oligo2) هستند. جهش Histone H3-lysine 27-to-methionine (K27M) اخیراً برای تشخیص تومورهای تالاموس مرتبط با diffuse midline glioma استفاده شده است(2). جهش Histone H3-K27M با بیماری تهاجمی و پیش آگهی ضعیف همراه است(4). از آنجا که این جهش معمولاً در midline یافت می شود، مکان آناتومیک این تومورها به شدت هر فرصتی را برای رزکسیون معنی دار (قابل توجه) محدود می کند، بنابراین درمان به روش های پرتو درمانی و شیمی درمانی هدفمند محدود می شود (5).
اندیکاسیونها
در حال حاضر، هیچ دستورالعمل استاندارد پذیرفته شده ای برای درمان خاص تومورها در ناحیه تالاموس وجود ندارد (3). اکثر جراحان مغز و اعصاب دستورالعمل های درمانی را اتخاذ می کنند که بر معادل های بافت شناسی در ناحیه لوبار منطبق است. این توصیهها عبارتند از رزکسیون بیخطر و شیمیدرمانی. برخی از جراحان بسته به تشخیص، روش stereotactic needle biopsy و درمان کمکی (adjuvant) را دنبال میکنند (2). هیدروسفالی علامت دار اغلب به مداخله جراحی برای قرار دادن شانت ventriculoperitoneal یا جراحی debulking نیاز دارد تا بتواند دینامیک مایع مغزی نخاعی native (CSF) را فعال کند.
توصیه هایی برای تعدادی از انواع تومورهای خاص وجود دارد. Pilocytic astrocytoma باید با حداکثر رزکسیون ایمن درمان شود، زیرا رزکسیون کامل یا حتی نزدیک به کامل ناخالص می تواند این بیماری را درمان کند. به طور گسترده پذیرفته شده است که thalamic diffuse midline glioma، صرف نظر از درجه آن، به دلیل نرخ بالای عوارض و مرگ قابلیت جراحی ندارد. درمان کمکی (adjuvant) برای تومورهایی توصیه میشود که مطابق با گلیوما درجه بالا در تصویربرداری هستند . حتی از بیوپسی هم اجتناب شود، زیرا بیوپسی میتواند منجر به بدتر شدن علائم در این بیماران با طول عمر کوتاه شود.
در مقابل، اگر تومور به سطح pial نزدیک شود و ویژگیهای رادیولوژیک حاکی از گلیوما با درجه پایین را داشته باشد ممکن است نیاز به مشاهده یا رزکسیون تومور وجود داشته باشد. بیوپسی برای تایید تشخیص و آزمایش مولکولی برای هدایت درمان توصیه می شود(2،3). رادیوسرجری را می توان برای تومورهای کوچک باقیمانده یا عود کننده، برای درمان کمکی گلیوماهای درجه بالاتر و برای تسکین در بیمارانی که قادر به تحمل رزکسیون نیستند، استفاده کرد.
همانند سایر تومورها، احتمال کاندیداتوری جراحی تومور با توانایی تومور برای نزدیک شدن به سطح pial که به آسانی در دسترس است، (مانند posterior pulvinar و تالاموس فوقانی به داخل بطن جانبی) افزایش مییابد.
ملاحظات قبل از عمل
انتخاب روش مناسب به منشاء، الگوی رشد تومور در رابطه با ساختارهای طبیعی و پاتولوژی مشکوک بستگی دارد. سطح راحتی و تجربه جراح با رویکرد انتخابی نیز عامل مهمی است. روشهای جراحی متعددی، از جمله روشهای anterior interhemispheric transcallosal، transcortical transventricular، contralateral infratentorial supracerebellar، posterior interhemispheric parasplenial و transsylvian transinsular توصیف شدهاند.
ملاحظات دیگر عبارتند از وجود هیدروسفالی، نزدیکی تومور به ساختارهای عصبی عروقی حیاتی، و محل ساختارهای ماده سفید مهم (corticospinal tracts). صرف نظر از رویکرد، جراح باید درک کاملی از آناتومی جراحی، قشر مغز و ماده سفید داشته باشد و باید به ساختارهای عروقی که در هر رویکرد با آن مواجه میشوند توجه خاصی داشته باشد.
آناتومی عمل
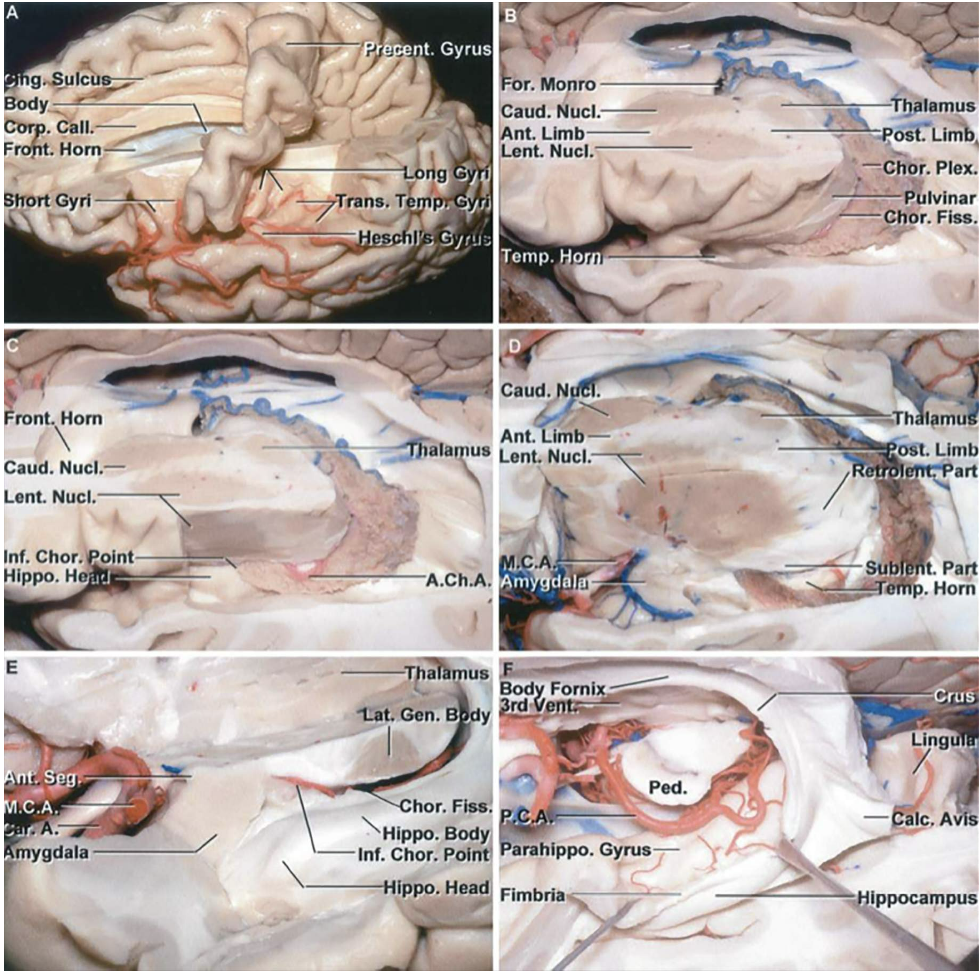
آناتومی جراحی منطقه پیچیده است و در اینجا فقط به طور خلاصه مرور می شود.
آناتومی وریدی
درک آناتومی ورید پاراساژیتال و deep diencephalic برای اجرای بسیاری از رویکردها مهم است. آناتومی ورید و تغییرات آن در اطراف superior parietal lobule باید قبل از جراحی برای مسیرهای بین نیمکره ای مورد توجه قرار گیرد. اگرچه وریدهای پاراساژیتال غالباً در این مکان پراکنده هستند، نیمکرههایی وجود دارند که اشکال تکراری غیرقابل تعویض ورید Trolard در آنها وجود دارد.
سیاهرگ های عمیق مانند ورید Galen می توانند دسترسی را از طریق رویکردهای supracerebellar پیچیده کنند.
6 ناحیه تشریحی تالاموس
تقسیم تالاموس به 6 ناحیه بر اساس رویکردهای عمل به هر منطقه و پیامدهای آن بسیار مفید است.
رزکسیون تومورهای تالاموس
برای رویکردهایی که دسترسی زودهنگام به CSF cisterns امکان پذیر نیست (یعنی مسیرهای بین نیمکره ای و supracerebellar در مقایسه با orbitozygomatic corridor)، تخلیه CSF حین عمل آرامش مغز (brain relaxation) را تسهیل می کند و مسیر عمل (operative trajectory) را گسترش می دهد. این مانور نیاز به جمع کننده های ثابت (fixed retractors) در نیمکره طبیعی را برطرف می کند. برای رسیدن به این منظو( اگر ایمن تلقی شود) lumbar drain روش انتخابی است. تقریباً 50 تا 60 میلی لیتر CSF به تدریج (در مقادیر 10 تا 15 میلی لیتری) از طریق درن کمر در طی کرانیوتومی و پس از باز شدن دورال خارج می شود.
برای مسیرهای بین نیمکره ای(interhemispheric routes)، بیمار در موقعیت park-bench قرار می گیرد و نیمکره سالم در وضعیت dependent position قرار می گیرد. این مانور به عقب نشینی گرانشی اجازه می دهد تا نیمکره وابسته (contralateral) را از خط وسط دور کند. بیمار در وضعیتی قرار می گیرد که گردن خود را 45 درجه به سمت بالا از زمین متمایل کرده است. با این حال، موقعیت بیمار (positioning) به روش جراحی مورد استفاده بستگی دارد و باید بر اساس آن تنظیم شود. ناوبری (Navigation) برای برنامه ریزی برش و کرانیوتومی برای جلوگیری از وریدها و برای طراحی کورتیکوتومی استفاده می شود.
به طور کلی، یک رویکرد contralateral interhemispheric نسبت به همتای همان طرف آن (ipsilateral counterpart) در صورت وجود اندیکاسیون ، یک رویکرد مناسب است. با توجه به اینکه این روش مسیر عمل جانبی (lateral operative trajectory) را گسترش می دهد در حالی که انقباض (retraction) نیمکره همان طرف را به حداقل می رساند. سینوس ساژیتال فوقانی و corresponding bridging veins روی superior parietal lobule باید با MRI قبل از عمل ارزیابی شوند و در صورت لزوم MRV یا CT آنژیوگرافی (CTA) انجام شود. وریدهای parasagittal bridging veins اغلب در این ناحیه پراکنده هستند، اما خطر انفارکتوس وریدی قابل توجه با بستن هر سیاهرگ بزرگ وجود دارد.
منطقه 1: تومورهای تالاموس قدامی تحتانی
رویکرد زیر پیشانی سوپراکاروتید اوربیتوزیگوماتیک (Orbitozygomatic Transsylvian Supracarotid Infrafrontal Approach)
این رویکرد دسترسی به تالاموس قدامی تحتانی (anteroinferior thalamus) را فراهم می کند. برای این رویکرد یک مسیر عملیاتی بسیار شیب دار inferior-to-superiorدر پایه جمجمه مورد نیاز است. بنابراین، کرانیوتومی اربیتوزیگوماتیک با فرورفتگی ملایم محتویات اربیتال با استفاده از بخیههای تراکشن دورال (dural retraction sutures) ضروری است.
پس از کرانیوتومی اربیتوزیگوماتیک، که در ناحیه اربیتال خلفی و anterior perforating substance انجام می شود، سخت شامه باز می شود و sylvian fissure تشریح می شود و عصب بویایی، مثلث سوپراکاروتید، M1 و A1 آشکار می شود.
در مرحله بعد، یک برش کورتیکال از جنبه جانبی عصب بویایی به سمت قسمت خلفی medial orbital gyrus با استفاده از navigation ایجاد می شود. شریان های سوراخ کننده ای که هسته دمی، گلوبوس پالیدوس، پوتامن، تالاموس قدامی و نیمه فوقانی کپسول داخلی را تامین می کنند، شناسایی شده و به آرامی تکان داده می شود( به کنار می رود)( gently mobilized). برای جلوگیری از اسپاسم آنها بسیار مهم است که با احتیاط از این عروق استفاده کنید و آنها را به طور مکرر در محلول پاپاورین حمام کنید. این عروق کالیبر بسیار کوچکی دارند و بنابراین بسیار آسیب پذیر هستند. آسیب آنها منجر به سکته مغزی کپسول داخلی می شود و نشان دهنده خطر اصلی این عمل است. توجه داشته باشید که شریان های عدسی (lenticulostriate arteries) که از شاخه های A1 و M1 نزدیک به وجود می آیند وارد perforating substance در این ناحیه می شوند و باید به دقت حفظ شوند.
راهرو جراحی حاصل عمیق تر می شود تا به تالاموس قدامی تحتانی برسد. برای این رویکرد، uncinate fascicle، diagonal band of Broca، substantia innominata و anterior commissure باید پس از برش قشر قطع شود.
روش Transrostral/Subfrontal Translamina Terminalis Approach
این روش برای دسترسی به ضایعات ترجیح داده می شود. بعد از کرانیوتومی سوپرا اربیتال همراه با osteotomy لبه اربیتال و exposure دورال ( بیمار در وضعیت خوابیده به پشت)، interhemispheric fissure به آرامی باز می شود. rostrum، lamina terminalis، A1s دو طرفه، شریان های سوراخ کننده و شریان ارتباطی قدامی دیده می شود.
از طریق مسیر transrostral، یک برش در امتداد lamina terminalis ابتدا massa intermedia و بطن سوم را آشکار می کند. anterior commissure را می توان در حاشیه anteroinferior margin پس از postcommissural fornix شناسایی کرد و medial anteroinferior thalamus درست در خلف سوراخ مونرو در مجاورت قدامی ترین قسمت choroidal plexus قرار دارد. در این روش، برداشتن rostrum منجر به آسیب به callosal fibers میشود. برای قرار گرفتن در معرض گسترده تر در امتداد بطن سوم، جراح می تواند پس از باز کردن lamina terminalis، anterior commissure را برش دهد(7).
این رویکرد محدود به تومورهای نسبتاً کوچک تالاموس قدامی تحتانی است. رزکسیون کلی تومورهای بزرگ معمولاً مشکل ساز است و بدون عقب نشینی غیرمجاز (undue retraction) در ساختارهای عصبی عروقی طبیعی اطراف امکان پذیر نیست. این رویکرد مناسب نیست و مسیر orbitozygomatic را که در بالا مورد بحث قرار گرفت، رویکرد بهتری است.
منطقه 2: تومورهای تالاموس داخلی
رویکرد Anterior Interhemispheric Transcallosal
رویکرد contralateral anterior interhemispheric transcallosal برای مواردی که مرکز تومور در ناحیه تالاموس قدامی و میانی قرار دارد و به سطح pial دیواره بطن سوم می رسد بهتر است. مسیر cross-court contralateral یک نمای عالی از ضایعه در دیواره داخلی بطن سوم ارائه می دهد.
کرانیوتومی به اندازه یک سوم پشت و دو سوم در جلوی coronal suture ایجاد می شود. medial extension کرانیوتومی روی سینوس ساژیتال فوقانی قرار می گیرد. سخت شامه به شکل نعل اسبی با پایه به سمت سینوس ساژیتال فوقانی باز می شود و به سمت سینوس منعکس می شود. برای جلوگیری از آسیب به وریدهای cortical bridge باید مراقب بود. bridging veins حفظ می شوند و برای افزایش ناحیهای که جراح روی آن کار می کند از طریق interhemispheric corridor کرانیوتومی انجام میشود.
دو بخیه نگهدارنده (retention sutures) در قسمت فوقانی falx قرار داده می شود تا انقباض ملایم سینوس دورال و حرکت دور از خط وسط را تسهیل کند. این مانور در گسترش دالان بین نیمکره ای مناسب است. یک تکه پد Telfa برای پوشاندن و محافظت از نیمکره طبیعی قرار داده شده است. شکاف بین نیمکره ای به صورت آتروماتیک زیر میکروسکوپ باز می شود. Pericallosal arteries، شریان های callosomarginal arteries و anterior body of the corpus callosum باید به راحتی در معرض دید قرار گیرند.
یک callosotomy 2 سانتی متری با هدایت navigationانجام می شود. پس از دسترسی به body بطن جانبی، چندین ساختار از جمله fornix، choroidal fissure، قسمت بطن جانبی تالاموس داخلی و هسته دمی در معرض دید قرار می گیرند. سوراخ مونرو با استفاده از مسیر transcallosal expanded transforaminal transvenous transchoroidal route بزرگ می شود . پس از باز شدن choroidal fissure قدامی، قسمتی از تالاموس داخلی که دیواره جانبی بطن سوم و وریدهای داخلی مغز را تشکیل میدهد، نمایان میشود. choroid plexus را در هنگام anterior transchoroidal dissection برای محافظت از fornices در سمت fornicealرها می کنیم. این روش در تضاد با روش اکثر جراحان است که معتقدند باید plexus را در سمت تالاموس رها کرد. حفاظت از fornices به دلیل عملکرد حیاتی fornicesدر حافظه از اهمیت بالایی برخوردار است.
اختلالات روانی گذرا پس از عمل یا نقص حافظه در برخی موارد ممکن است رخ دهد. علاوه بر این، وقتی midcallosal fibers جدا میشوند، بینظمیهای گفتاری موقتی ممکن است رخ دهد.
روش Suprapineal Recess/Supracerebellar Transventricular:
این روش دسترسی به قسمت بطن سوم خلفی تالاموس را از طریقsuprapineal recess فراهم می کند. کرانیوتومی midline suboccipital supracerebellar استاندارد یا اپروچ contralateral paramedian supracerebellar انجام می شود. از طریق این راهرو کوچک، quadrigeminal cistern با پیشروی بر روی سطح چادری مخچه باز می شود. غده pineal ، ورید Galen، ورید basal و وریدهای داخلی مغزی (internal cerebral) و internal occipital دیده می شود.
پس از اینکه هر دو قسمت خلفی میانی (منطقه 6) و cisternal (منطقه 4) تالاموس در معرض دید قرار گرفتند، می توان به قسمت سوم بطن تالاموس داخلی بین غده pineal در قسمت تحتانی و ورید Galen دسترسی داشت. پس از ورود به بطن سوم، aqueduct می تواند در قاعده در معرض دید قرار می گیرد، در حالی که قسمت بطن سوم تالاموس داخلی به صورت جانبی در دسترس است.
از معایب این روش می توان به آسیب پذیری habenula، رگ Galen و quadrigeminal plate اشاره کرد. اکثر نقایص مربوط به دستکاری، موقتی هستند. علاوه بر این، این مسیر جراحی یکی از معدود مداخلات transcranial transcisternal است که در آن آندوسکوپی نسبت به روش جراحی میکروسکوپی (microsurgical) برتری دارد. قسمتی که در معرض دید قرار می گیرد بسیار محدود است و راهرو (corridor) بسیار طولانی است.
منطقه 3: تومورهای تالاموس جانبی
روش Contralateral Anterior Interhemispheric Transcallosal Approach
این روش به قسمت جانبی تالاموس اجازه می دهد تا در دسترس باشد. سر به گونه ای قرار می گیرد که ضایعه در تالاموس غیر وابسته (nondependent thalamus) باشد و کرانیوتومی در سمت مقابل ضایعه انجام شود.
جزئیات تشریح در بالا توضیح داده شده است. قابل ذکر است که بعد از callosotomy وارد بطن جانبی طرف مقابل می شود. به عنوان یک نتیجه از رویکرد طرف مقابل (contralateral approach)، از طریق این اپروچ یک مسیر عرضی جانبی امکان پذیر (more feasible lateral cross-court trajectory) به سمت تالاموس جانبی به دست می آید. در هنگام برداشتن ضایعات تالاموس جانبی به دلیل مجاورت نزدیک کپسول داخلی باید احتیاط کرد.
در تومورهای ضروری و با موقعیت داخلی که به دیواره داخلی بطن سوم نزدیک می شوند، سوراخ مونرو با استفاده از مسیر transcallosal expanded transforaminal transvenous transchoroidal route. بزرگ می شود
-
منابع:
REFERENCES
- Cao L, Li C, Zhang Y, et al. Surgical resection of unilateral thalamic tumors in adults: approaches and outcomes. BMC Neurol 2015;15:229. doi.org/10.1186/s12883-015-0487-x
- Moses ZB, Friedman GN, Abd-El-Barr MM, et al. Tumors of the thalamus. In Spetzler RF, Kalani MYS, Lawton MT, eds, Surgery of the Brainstem. Thieme; 2020. doi.org/10.1055/b-0039-173906
- Ajlan A, Recht L. Neuro-oncologic considerations for pineal, thalamic, and brainstem tumors. In Spetzler RF, Kalani MYS, Lawton MT, eds, Surgery of the Brainstem. Thieme; 2020. doi.org/10.1055/b-0039-173913
- Solomon DA, Wood MD, Tihan T, et al. Diffuse midline gliomas with histone H3-K27M mutation: a series of 47 cases assessing the spectrum of morphologic variation and associated genetic alterations. Brain Pathol 2016;26:569–580. doi.org/10.1111/bpa.12336
- Himes BT, Zhang L, Daniels DJ. Treatment strategies in diffuse midline gliomas with the H3K27M mutation: the role of convection-enhanced delivery in overcoming anatomic challenges. Front Oncol 2019;9:31. doi.org/10.3389/fonc.2019.00031
- Rangel-Castilla L, Spetzler RF. The 6 thalamic regions: surgical approaches to thalamic cavernous malformations, operative results, and clinical outcomes. J Neurosurg 2015;123:676–685. doi.org/10.3171/2014.11.Jns14381
- Baran O, Baydin S, Gungor A, et al. Surgical approaches to the thalamus in relation to the white matter tracts of the cerebrum. World Neurosurg 2019;128:e1048–e1086. doi.org/10.1016/j.wneu.2019.05.068
- Belykh E, Yağmurlu K, Lei T, et al. Quantitative anatomical comparison of the ipsilateral and contralateral interhemispheric transcallosal approaches to the lateral ventricle. J Neurosurg 2018;128:1492–1502. doi.org/10.3171/2017.1.Jns161338
- Eichberg DG, Buttrick SS, Sharaf JM, et al. Use of tubular retractor for resection of colloid cysts: single surgeon experience and review of the literature. Oper Neurosurg (Hagerstown) 2019;16:571–579. doi.org/10.1093/ons/opy249
- Gassie K, Alvarado-Estrada K, Bechtle P, Chaichana KL. Surgical management of deep-seated metastatic brain tumors using minimally invasive approaches. J Neurol Surg A Cent Eur Neurosurg 2019;80:198–204. doi.org/10.1055/s-0038-1676575
مقالات مرتبط
داروی تترابنازین Tetrabenazine
تترابنازین داروی موثر در درمان سایکوز است که همچنین در درمان هانتینگتون نیز بکار میرود اطلاعات این دارو شامل
فناوری پیشرفته بهبود بیماران مبتلا به صرع مقاوم به دارو
مایو کلینیک از فناوری های پیشرفته برای بهبود درمان بیماران مبتلا به صرع مقاوم به دارو استفاده می کند. رویکرد کلینیک حول دو جزء کلیدی می چرخد: روش های تصویربرداری پیشرفته و تحریک عصبی و همچنین درمان های Ablative .