کنسر غده پینه آل
خلاصه مقاله
غده پینهآل یا غده کاجی یا غده اپیفیز یا غده صنوبری تودهٔ بافتی مخروطیشکل کوچکی است که در خط وسط مغز، در قسمت فوقانی مرز خلفی بطن سوم قرار دارد. در نمای تاجی، غده در زیر چنبره جسم پینه ای و بالا و خلف تکتوم مغز میانی قرار دارد. این غده درونریز و متشکل از سلولهای پینهآل و بینابینی میباشد و در عمق مغز (دیانسفال) و در بین دو نیمکره چپ و راست مخ قرار دارد. هورمون ملاتونین و سروتونین را ترشح میکند. سلول های اصلی غده صنوبری پینه آلوسیت ها هستند. ساختارهای تشریحی مهم در مجاورت غده صنوبری عبارتند از: قدامی: بطن سوم - قدامی فوقانی: هسته هابنولار - فوقانی: وریدهای داخلی مغز، ورید جالینوس ، استریا مدولاریس، چنبره جسم پینه ای و velum interpositum - خلفی تحتانی: مخزن مخچه فوقانی - پایین: کولیکول های فوقانی مغز میانی - قدامی تحتانی: کمیسور خلفی. علت تومورهای غده صنوبری بر اساس طبقه بندی هیستوپاتولوژیک: تومورهای پارانشیم صنوبری - پینهوسیتوم - تومور پارانشیم پینه آل با تمایز متوسط - پینهئوسیتوم - تومور پاپیلاری ناحیه پینه آل - تومورهای سلول زایا - تومورهای سلول زایای ژرمینوماتوز - تومورهای سلول زایای غیر ژرمینوماتوز - کارسینوم جنینی - تراتوم نابالغ و بالغ ، ... می توان نام برد. تومورهای سلول زایا با سندرم کلاین فلتر، سندرم داون و نوروفیبروماتوز نوع 1 ارتباطی وجود دارد. هم چنین بر اساس هیستواتولوژی پینه آل را می توان به :پینهئوسیتوم - تومورهای پارانشیمی پینه آل با تمایز متوسط - تومور پاپیلاری ناحیه پینه آل - پینئوبلاستوم - ژرمینوما تقسیم بندی کرد. تظاهرات بالینی برای همه تومورهای ناحیه پینه آل ثانویه به هیدروسفالی انسدادی و فشرده سازی تکتوم است مانند : هیدروسفالی - سه گانه کوشینگ - تورم دو طرفه عصب بینایی - فلج دو طرفه عصب ششم - فشرده سازی تکتوم (سندرم پارینو) - اختلال در دید رو به بالا و دید رو به پایین - فشرده سازی مرکز نگاه عمودی در هسته بینابینی medial longitudinal fasciculu - تفکیک نور نزدیک - فشرده سازی هسته پرتکتال در کولیکول فوقانی - نیستاگموس همگرایی - جمع شدن پلک - آسیب به رشته های فوق هسته ای عصب سوم در مغز میانی خلفی. از تست های تشخیصی شامل AFP، b-HCG و آلکالین فسفاتاز جفتی می باشند. تجزیه و تحلیل CSF، که در صورت عدم وجود هیدروسفالی یا با پونکسیون کمری، برای اکثر تومورها مفید است. تصویربرداری : (MRI) با و بدون افزایش گادولینیوم استاندارد طلایی ارزیابی تومورهای ناحیه پینه آل است. با این حال، اگر در دسترس نباشد، CT ( کلسیفیکاسیون در غده صنوبری بزرگسالان )، آنژیوگرافی و سونوگرافی (در نوزادان) نقش دارند. متاستاز CSF را می توان در پینئوبلاستوما (متاستاز دیستال ) و در ژرمینوم ها (متاستاز پروگزیمال) مشاهده کرد. برای درمان : در صورت عدم وجود هیدروسفالی --> تومور مارکرهای به دست آمده --> در صورت مثبت بودن --> درمان براساس آسیب شناسی: • اگر تشخیص منفی : بیوپسی (استریوتاکتیک، آندوسکوپی). یا رزکسیون (بر اساس یافته های اولیه رادیوگرافی یا یافته های پاتولوژی) • در صورت وجود هیدروسفالی --> انحراف مایع CSF؛ بهترین گزینه آندوسکوپی ونتریکولوستومی سوم (همیشه در طول ETV بیوپسی رااز قسمت خلفی بطن سوم انجام دهید) --> ونتریکولوستومی آندوسکوپی سوم برداشتن و جراحی: تمام تومورهای پارانشیم پینه آل, تراتوم بالغ, تومور باقیمانده پس از شیمی درمانی + رادیوتراپی تشخیص های افتراقی:ضایعات غیر نئوپلاستیک کیستیک- کیست پینه آل - cavum veli interpositum - کیست عنکبوتیه - تومورهای پارانشیم صنوبری - تومورهای سلول زایا - تومورهای ناحیه پینه آل تومور می تواند منجر به عوارض مختلفی شود: اختلال عملکرد هیپوتالاموس و غدد درون ریز - اختلال در عملکرد حرکت خارج چشم - خونریزی - انفارکتوس وریدی - تشنج - همی پارزی - آتاکسی
مقدمه:
غده پینهآل (به انگلیسی: pineal gland) یا غده کاجی یا غده اپیفیز (به لاتین: epiphysis cerebri) یا غده صنوبری که به چشم سوم نیز معروف است تودهٔ بافتی مخروطیشکل کوچکی است که که در خط وسط مغز، در قسمت فوقانی مرز خلفی بطن سوم قرار دارد. در نمای تاجی، غده در زیر چنبره (splenium) جسم پینه ای و بالا و خلف تکتوم (tectum) مغز میانی قرار دارد. این غده درونریز است و متشکل از سلولهای پینهآل و بینابینی میباشد و در عمق مغز (دیانسفال) و در بین دو نیمکره چپ و راست مخ قرار دارد. کارکرد دقیق آن هنوز مشخص نیست، البته این غده هورمونی به نام ملاتونین و ماده شیمیایی به نام سروتونین را ترشح میکند که ترشح این هورمونها در شب به حداکثر و در نزدیکی ظهر به حداقل خود میرسد. همچنین با چرخه روزانه خواب و بیداری مرتبط میباشد.
تومورهای ناحیه پینه آل نادر هستند و 1 درصد از کل تومورهای داخل جمجمه ای را در بزرگسالان و تا 8 درصد را در کودکان تشکیل می دهند. این تومور به دلیل تنوع سلول ها در غده و ساختارهای واقع در مجاور غده با آسیب شناسی های متعددی همراه است. سلول های اصلی غده صنوبری پینه آلوسیت ها (سلول های پارانشیم صنوبری) هستند. تومورهای غده صنوبری به آنهایی که از پارانشیم صنوبری، تومورهای سلول زایا و ضایعات ناشی از ساختارهای مجاور ایجاد می شوند، طبقه بندی می شوند. سایر ضایعات مجاورغده آستروسیتوما، الیگودندروگلیوما، کیست گلیال (کیست پینه آل)، مننژیوم، کیست آراکنوئید، اپاندیموم، کمودکتوما، اپیدرموئید، درموئید، متاستاز، آنوریسم ورید جالینوس، بدشکلی شریانی ورید و سیستیسرکوزیس می باشد.
ساختارهای تشریحی مهم در مجاورت غده صنوبری عبارتند از:
- قدامی: بطن سوم (pineal recess)
- قدامی فوقانی: هسته هابنولار
- فوقانی: وریدهای داخلی مغز، ورید جالینوس (خلفی)، استریا مدولاریس، چنبره (splenium) جسم پینه ای و velum interpositum.
- خلفی تحتانی: مخزن مخچه فوقانی
- پایین: کولیکول های فوقانی مغز میانی
- قدامی تحتانی: کمیسور خلفی
اتیولوژی
علت تومورهای غده صنوبری بر اساس طبقه بندی هیستوپاتولوژیک به شکل زیر است:
- تومورهای پارانشیم صنوبری
- پینهوسیتوم
- تومور پارانشیم پینه آل با تمایز متوسط
- پینهئوسیتوم
- تومور پاپیلاری ناحیه پینه آل
- تومورهای سلول زایا
- تومورهای سلول زایای ژرمینوماتوز:
- ژرمینوم صنوبری
- تومورهای سلول زایای غیر ژرمینوماتوز:
- کوریوکارسینوما
- کارسینوم جنینی
- تومور کیسه زرده (تومور دستگاه سینوس اندودرمی)
- تراتوم نابالغ
- تراتوم بالغ
پاتوفیزیولوژی
تومورهای ناحیه پینه آل به دلیل مجاورت ساختارهای تشریحی متعدد منشأ متنوعی دارند. غده صنوبری برای جداسازی سلول های زایای جنینی رایج است. بنابراین، تومورهای سلول زایا از شایع ترین آسیب شناسی های موجود در این ناحیه هستند.
تومورهای سلول زایا معمولاً به صورت پراکنده رخ می دهند. با این حال، ارتباطی با سندرم کلاین فلتر، سندرم داون و نوروفیبروماتوز نوع 1 وجود دارد.
تومورهای ناحیه پینه آل به طور کلی به صورت زیر طبقه بندی می شوند:
- تومورهای پارانشیم صنوبری
- تومورهای سلول زایا
- تومورهای سلول مجاور (آستروسیت ها، arachnoid cap cells)
- متاستازها
هیستوپاتولوژی
- پینهئوسیتوم
متشکل از سلولهای کوچکی که از نظر ظاهری شبیه به پینهآلوسیتهای معمولی هستند که در صفحاتی مرتب شدهاند. کاذب پینهئوسیتوماتوز مشخصه است و در بافت سالم غده صنوبری دیده نمی شود. پینوسیتوز های سد خونی مغزی به خوبی شکل گرفته ندارند و به همین دلیل با کنتراست به وضوح افزایش می یابند. سیناپتوفیزین: مثبت؛ پروتئین نوروفیلامنت: مثبت، انولاز اختصاصی نورون: مثبت، سایر نشانگرهای عصبی (پروتئین Tau، کروموگرانین-A، 5-HT): متغیر، هسته های عصبی: منفی
- تومورهای پارانشیمی پینه آل با تمایز متوسط
به طور مشخص دو الگوی میکروسکوپی متمایز را نشان می دهد. الگوی لوبول دار لوبول هایی با تعریف ضعیف را نشان می دهد که توسط عروق فیبری بزرگ از یکدیگر جدا شده اند. الگوی پراکنده یادآور الیگودندروگلیوما یا نوروسیتوم مرکزی است، با ependymal rosettes بزرگ پینهئوسیتوماتوز مشخصه پینهئوسیتوما مشهود نیست. سیناپتوفیزین: مثبت، پروتئین نوروفیلامنت: متغیر، هسته های عصبی: منفی
- تومور پاپیلاری ناحیه پینه آل
مورفولوژی متغیر، از جامد تا عمدتاً پاپیلاری، که یادآور اپندیموم است، از جمله شواهدی از rosettes های اپاندیمی را نشان می دهد. مناطق نکروز گاهی اوقات وجود دارد. سیتوکراتین ها (AE1/3، CAM5.2، KL1، CK18): مثبت، S100: مثبت، ویمنتین: مثبت، ترانس تیرتین: مثبت، انولاز اختصاصی نورون: مثبت، پروتئین مرتبط با میکروتوبول 2: مثبت، پروتئین اسیدی فیبریلی گلیال: متغیر
- پینئوبلاستوم
سلول های آبی گرد کوچک اصطلاحا با بسته بندی محکم (نسبت هسته ای به سیتوپلاسمی بالا): rosettes هومر رایت و گل رز فلکسنر-وینترشتاینر گاهی دیده می شود. مناطق نکروز اغلب مواجه می شوند. میزان میتوزی معمولاً زیاد است. سیناپتوفیزین: مثبت، SMARCB1: مثبت، سایر نشانگرهای عصبی (انولاز اختصاصی نورون، پروتئین نوروفیلامنت و کروموگرانین-A): متغیر
- ژرمینوما
ژرمینوم ها از سلول های زایای اولیه منشا می گیرند، مشابه سلول های ژرمینوم گناد. سلولها دارای هستههای بزرگ و برجسته هستند. انفیلتراسیون لنفوسیتی شایع است. نمونههای CSF میتوانند آلکالین فسفاتاز جفتی و b-HCG را نشان دهند.
هیستوری
تظاهرات بالینی برای همه تومورهای ناحیه پینه آل ثانویه به هیدروسفالی انسدادی و فشرده سازی تکتوم است. بنابراین، صرف نظر از آسیب شناسی، یافته های معاینه فیزیکی برای همه تومورها مشابه خواهد بود.
- هیدروسفالی:
سابقه: سردرد، تهوع، اختلال رشد، ماکروسفالی، تاری دید، خواب آلودگی یا کما.
- سه گانه کوشینگ (فشار خون بالا، برادی کاردی و تنفس نامنظم)
- تورم دو طرفه عصب بینایی
- فلج دو طرفه عصب ششم
- فشرده سازی تکتوم (سندرم پارینو):
سابقه: مشکل در راه رفتن در طبقه بالا، دوبینی
- اختلال در دید رو به بالا و دید رو به پایین
- فشرده سازی مرکز نگاه عمودی (vertical gaze center) در هسته بینابینی medial longitudinal fasciculu
- تفکیک نور نزدیک
- فشرده سازی هسته پرتکتال در کولیکول فوقانی
- نیستاگموس همگرایی - جمع شدن پلک (Collier sign)
- آسیب به رشته های فوق هسته ای عصب سوم در مغز میانی خلفی.
تست های تشخیصی
- نشانگرهای سرم تومور در زمانی که به تومورهای خاص مشکوک هستند نشان داده میشوند و شامل AFP، b-HCG و آلکالین فسفاتاز جفتی می باشند.
- تجزیه و تحلیل CSF، که در صورت عدم وجود هیدروسفالی یا با پونکسیون کمری، برای اکثر تومورها مفید است.
- تصویربرداری:
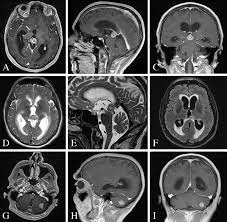
تصویربرداری رزونانس مغناطیسی مغز (MRI) با و بدون افزایش گادولینیوم استاندارد طلایی ارزیابی تومورهای ناحیه پینه آل است. با این حال، اگر در دسترس نباشد، اسکن توموگرافی کامپیوتری سر (CT)، آنژیوگرافی و سونوگرافی (در نوزادان) نقش دارند.
یافته های طبیعی در تصویربرداری عصبی از غده صنوبری:
سی تی اسکن: کلسیفیکاسیون در غده صنوبری بزرگسالان معمول است. در کودکان زیر 5 سال، کلسیفیکاسیون وجود ندارد. کلسیفیکاسیون غده صنوبری در حدود 30 سالگی بزرگ می رسد.
MRI: غده شبیه به شدت ماده خاکستری است و به صورت یک گره کوچک بافتی در قسمت خلفی بطن سوم ظاهر میشود. به دلیل قرار گرفتن در خارج از سد خونی مغزی، به شدت با گادولینیوم واضح دیده می شود و اغلب کلسیفیکاسیون ها مشاهده می شود.
تومورهای متراکم، مانند پینئوبلاستوما و ژرمینوما، انتشار محدودی در تصاویر دارند. از سوی دیگر، کیستهای پینهآل معمولاً دیوارهای نازک دارند بنابراین، یک دیوار ضخیم، تشخیص کیست را حذف می کند.
کلسیفیکاسیون ها اغلب وجود دارند و در سی تی اسکن سر به راحتی قابل شناسایی هستند. تومورهای پارانشیم صنوبری (مانند پینئوسیتوما یا پینئوبلاستوما) تمایل دارند کلسیفیکاسیون محیطی را پراکنده کنند، در حالی که تومورهای سلول زایای تمایل دارند کلسیفیکاسیون ها را ببلعد. یک راه آسان برای به خاطر سپردن این موضوع این است که پینئوبلاستوم ها تمایل دارند کلسیفیکاسیون ها را از هم جدا کنند.
بسیاری از تومورهای ناحیه پینه آل ممکن است باعث متاستاز موضعی یا دوردست شوند. بنابراین، ام آر آی کامل ستون فقرات ممکن است به عنوان بخشی از ارزیابی اولیه در نظر گرفته شود. تهاجم موضعی و متاستاز از راه دور برای پیش آگهی مهم هستند و ممکن است مدیریت اولیه و درمان کمکی را به شدت تغییر دهند.
یافتههایی که میتوانند به پیشآگهی بدتر اشاره کنند شامل تهاجم موضعی، متاستاز CSF، و ادم دور تومور گسترده است.
تهاجم موضعی را می توان در پینئوبلاستوم و اکثر تومورهای سلول زایای مشاهده کرد.
متاستاز CSF را می توان در پینئوبلاستوما (متاستاز دیستال شایع ترین است) و در ژرمینوم ها (متاستاز پروگزیمال شایع ترین است) مشاهده کرد.
درمان / مدیریت
پیروی از الگوریتم های درمانی برای اطمینان از تشخیص و درمان کافی ضروری است.
- در صورت عدم وجود هیدروسفالی:
تومور مارکرهای به دست آمده (سرم و CSF).
- در صورت مثبت بودن، درمان براساس آسیب شناسی
- اگر تشخیص منفی بافت ضروری است:
بیوپسی (استریوتاکتیک، آندوسکوپی).
- رزکسیون (بر اساس یافته های اولیه رادیوگرافی یا یافته های پاتولوژی)
مدیریت نهایی بر اساس آسیب شناسی است.
- در صورت وجود هیدروسفالی:
انحراف مایع CSF؛ بهترین گزینه آندوسکوپی ونتریکولوستومی سوم (ETV) است.
همیشه در طول ETV بیوپسی را انجام دهید
- ونتریکولوستومی آندوسکوپی سوم:
این کار با فنستراسیون کف بطن سوم انجام می شود، بنابراین یک گذرگاه بین بطن سوم و مخازن پرپونتین ایجاد می شود.
در بیشتر موارد، سوراخ فرونتال راست (درست جلوی نقطه کوچر) انجام می شود و آندوسکوپ عصبی تا رسیدن به بطن جانبی همان طرف جلو می رود. از طریق سوراخ همان طرف مونرو، کف بطن سوم (tuber cinereum) فنر شده و منبسط می شود تا جریان CSF کافی را فراهم کند.
بیوپسی از قسمت خلفی بطن سوم گرفته می شود.
اگر بطن سوم شکست بخورد، درمان قطعی قرار دادن شانت بطنی است.
امتیاز موفقیت ETV از سه متغیر برای محاسبه استفاده می کند. سن، علت هیدروسفالی و قرار دادن قبلی شانت بطنی. برای محاسبه امتیاز موفقیت، باید درصد موفقیت را برای هر متغیر جمع کرد. کمترین امتیاز 0% و بالاترین آن 90% است.
سن:
<1 ماه = 0%
1 تا 6 ماه = 10%
6 ماه تا 1 سال = 30٪
1 تا 10 سال = 40٪
> 10 سال = 50٪
علت هیدروسفالی:
پس از عفونی = 0٪
میلومننگوسل، خونریزی داخل بطنی و تومور غیرتکتال = 20%
تومور تککتال، تنگی قنات یا موارد دیگر = 30%
محل قبلی شانت بطنی:
بله = 0%
خیر = 10%
- برداشتن و جراحی: تمام تومورهای پارانشیم پینه آل, تراتوم بالغ, تومور باقیمانده پس از شیمی درمانی + رادیوتراپی (به اصطلاح "جراحی نگاه دوم")
- رادیوتراپی ( برای بیماران بالای 3 سال):
ژرمینوما
شیمی درمانی به علاوه رادیوتراپی (شیمی درمانی به تنهایی در سن کمتر از 3 سال):
شیمی درمانی کمکی به همراه رادیوتراپی برای همه تومورها به جز پینئوسیتوما و تراتوم بالغ در صورت رزکسیون کامل انجام می شود.
تمام تومورهای سلول زایای غیر ژرمینوماتوز
تومورهای سلول زایای ژرمینوماتوز در سن کمتر از 3 سال.
رویکرد جراحی به ناحیه پینه آل بر اساس محل خاص آسیب شناسی و ترجیح جراح انتخاب می شود:
- برداشتن فوق مخچه پارامدین فروتنتوریال: برای تمام تومورهای ناحیه پینه آل به جز تومورهای بزرگ که به سمت جانبی و تحتانی گسترش می یابند مفید است.
- کرانیوتومی ساب اکسیپیتال سمت چپ برای محافظت از تورکولا و وریدهای غالباً سمت راست و سینوسهای دورال از جمله سینوس عرضی انجام میشود. انعطاف پذیرترین روش برای برداشتن اکثر تومورهای ناحیه پینه آل.
- رزکسیون فوق مخچه ای زیر مغزی وسط: برای افشای تومورهای ناحیه پینه آل استفاده می شوند. از طریق کرانیوتومی دو طرفه ساب اکسیپیتال خط وسط انجام شد. محدودیت های این رویکرد شامل تجسم محدود جانبی یا تحتانی است که به ترتیب ناشی از زاویه تنتوریوم و راس انسدادی کولمن است. تقریباً تمام وریدهای ورمین خط میانی همواره قربانی می شوند.
- رزکسیون اکسیپیتال ترانس تنتوریال: به ویژه برای تومورهای بزرگ ناحیه پینه آل که به سمت جانبی و تحتانی گسترش می یابند مفید است. از طریق کرانیوتومی اکسیپیتال یک طرفه انجام می شود.محدودیتهای این رویکرد شامل دشواری جهتگیری آناتومیک، نیاز به تقسیم تنتوریوم و احتمال همیانوپی همنام از پسرفتن لوب اکسیپیتال است.
- غربالگری نورواکسیس کامل با تمام تومورهای ناحیه پینه آل بسیار مهم است. پیش آگهی و درمان به طور چشمگیری بسته به گسترش CSF تومور متفاوت است. متاستاز CSF از راه دور (به جز ژرمینوما) و متاستاز قطره ای پیش آگهی بدی دارند. MRI مغز، گردن، قفسه سینه و ستون فقرات کمری با و بدون کنتراست برای غربالگری کافی نوراکسیس مورد نیاز است. رادیوتراپی ستون فقرات به عنوان یک درمان پیشگیرانه بحث برانگیز است.
تشخیص های افتراقی
- ضایعات غیر نئوپلاستیک کیستیک:
- کیست پینه آل
- cavum veli interpositum
- کیست عنکبوتیه
- تومورهای پارانشیم صنوبری:
پینئوسیتوما
تومور پارانشیم پینه آل با تمایز متوسط
پینئوبلاستوم
تومور پاپیلاری ناحیه پینه آل
- تومورهای سلول زایای:
ژرمینوم صنوبری
کارسینوم جنینی
کوریوکارسینوما
تراتوم (بالغ/نابالغ)
تومور کیسه زرد
- تومورهایی که در ناحیه پینه آل نیز مشاهده می شوند:
آستروسیتوم
مننژیوم
متاستازهای مغزی
متاستازهای غده صنوبری
- ضایعات عروقی:
ورید آنوریسم/ناهنجاری گالن
ترومبوز ورید مغزی داخلی
عوارض
تومور می تواند منجر به عوارض مختلفی شود:
- اختلال عملکرد هیپوتالاموس و غدد درون ریز
- اختلال در عملکرد حرکت خارج چشم
- خونریزی
- انفارکتوس وریدی
- تشنج
- همی پارزی
- آتاکسی
منابع
-
- Coco, J. A., Kurtz, M. W. Benko, M. J., Jarrett, R. W, Rogers, CM, Witcher, M. R., and Marvin, E. A. (2020). Pineal gland metastasis from poorly differentiated carcinoma of unknown primary origin. Frontiers in Endocrinology, 11, 597773.
- Favero G, Bonomini F, Rezzani R. Pineal Gland Tumors: A Review. Cancers (Basel). 2021 Mar 27;13(7):1547. doi: 10.3390/cancers13071547. PMID: 33801639; PMCID: PMC8036741.
- Mayol del Valle, M., and De Jesus, O. (2020). Cancer of the pineal gland.
مقالات مرتبط
تومور های هیپوفیزی عملکردی
آدنوماهای هیپوفیزی تودههای رشدیافتهای از سلولهای مونوکلونال با علائم تولید بیش از حد هورمونی، با یا بدون پرزانتاسیون عصبی هستند. پرولاکتینوماها، آدنوماهای غیرعملکردی هیپوفیز، آدنوماهای تولیدکنندهی هورمون رشد، آدنوماهای تولیدکنندهی هورمون آدرنوکورتیکوتروپین، آدنوماهای مولد هورمون تحریککنندهی تیرویید، آدنوماهای تولیدکنندهی گنادوتروپین و اینسیدنتالوماها نمونههایی از تومورهای هیپوفیزیاند. آدنوماهای هیپوفیزی براساس سایز به دستهی میکروآدنوم با سایز کمتر از یک میلیمتر و ماکرو آدنوم تقسیم میشوند.تومورهای منشا رده سلولی Pit-1 , مسوول تولید بیش از حد هورمون ادرنوکورتیکوتروپین اند. تومور های منشا رده سلولی TPIT ,با رشد خوشخیم و تولید بیش از حد هورمون رشد, پرولاکتین وTSH همراه اند. عملکرد بیش از حد گنادوتروپین ممکن است با علائم اثر تودهای، هیپوفیز یا حتی بدون علامت ظاهر شود. تشخیص بر اساس علائم بالینی است. اگر نشانهای از ترشح بیش از حد هورمون هیپوفیز وجود داشته باشد، آدنوم باید خارج شود.پانل هورمونی :پرولاکتین سرم، فاکتور رشد شبه انسولین 1 ، تست عملکرد تیروئید، همورمون لوتئینیزهکننده، هورمون تحریک فولیکولی، ارزیابی کورتیزول با آزمایش کورتیزول ۲۴ ساعته ادرار ، کورتیزول بزاق اواخر شب و سرکوب دگزامتازون است. اگر پرولاکتین سرم بیش از ۲۵۰ میکروگرم در لیتر باشد، احتمالات : پرولاکتینوما، کم کاری تیروئید، اثرات فشاری آدنوم کمعملکرد، بارداری و نارسایی کلیوی باید در نظر گرفته شود.همه بیماران با یا بدون علائم بینایی، یا با درگیری عصب بینایی در تصویربرداری باید تحت ارزیابی کامل میدان بینایی قرار گیرند. درگیری عصب جمجمه و علائم عصبی، شک به توده جمجمه را ایجاد میکند و MRI با یا بدون کنتراست گادولینیوم اجباری است. در صورت منع مصرف MRI یا CT برش نازک از مغز انجام می گردد. درمان جراحی ترانس اسفنوئیدال برای کاهش حجم توده ، رادیوتراپی و دارودرمانیبیشتر پرولاکتینومها با کابرگولین و بروموکریپتین (بیماران باردار) است. جراحی در آدنومهای تولید بیش از حد آدرنوکورتیکوتروپین مؤثر، اما در موارد غیر قابل تحمل، کتوکونازول، متیراپون و میفپریستون کاهش دهنده علائم هستند. اکترئوتید و لانروتید برای مهار هورمونهای رشد استفاده و در آکرومگالی، پگوویزومانت مفید است.
هرآنچه در مدیریت هایپوناترمی مهم است.
هایپوناترمی شرایط خطرناکی است که در بیماران بویژه بیماران جراحی مغز و اعصاب بسیار خطرناک است.