تومور های هیپوفیزی عملکردی
خلاصه مقاله
آدنوماهای هیپوفیزی تودههای رشدیافتهای از سلولهای مونوکلونال با علائم تولید بیش از حد هورمونی، با یا بدون پرزانتاسیون عصبی هستند. پرولاکتینوماها، آدنوماهای غیرعملکردی هیپوفیز، آدنوماهای تولیدکنندهی هورمون رشد، آدنوماهای تولیدکنندهی هورمون آدرنوکورتیکوتروپین، آدنوماهای مولد هورمون تحریککنندهی تیرویید، آدنوماهای تولیدکنندهی گنادوتروپین و اینسیدنتالوماها نمونههایی از تومورهای هیپوفیزیاند. آدنوماهای هیپوفیزی براساس سایز به دستهی میکروآدنوم با سایز کمتر از یک میلیمتر و ماکرو آدنوم تقسیم میشوند.تومورهای منشا رده سلولی Pit-1 , مسوول تولید بیش از حد هورمون ادرنوکورتیکوتروپین اند. تومور های منشا رده سلولی TPIT ,با رشد خوشخیم و تولید بیش از حد هورمون رشد, پرولاکتین وTSH همراه اند. عملکرد بیش از حد گنادوتروپین ممکن است با علائم اثر تودهای، هیپوفیز یا حتی بدون علامت ظاهر شود. تشخیص بر اساس علائم بالینی است. اگر نشانهای از ترشح بیش از حد هورمون هیپوفیز وجود داشته باشد، آدنوم باید خارج شود.پانل هورمونی :پرولاکتین سرم، فاکتور رشد شبه انسولین 1 ، تست عملکرد تیروئید، همورمون لوتئینیزهکننده، هورمون تحریک فولیکولی، ارزیابی کورتیزول با آزمایش کورتیزول ۲۴ ساعته ادرار ، کورتیزول بزاق اواخر شب و سرکوب دگزامتازون است. اگر پرولاکتین سرم بیش از ۲۵۰ میکروگرم در لیتر باشد، احتمالات : پرولاکتینوما، کم کاری تیروئید، اثرات فشاری آدنوم کمعملکرد، بارداری و نارسایی کلیوی باید در نظر گرفته شود.همه بیماران با یا بدون علائم بینایی، یا با درگیری عصب بینایی در تصویربرداری باید تحت ارزیابی کامل میدان بینایی قرار گیرند. درگیری عصب جمجمه و علائم عصبی، شک به توده جمجمه را ایجاد میکند و MRI با یا بدون کنتراست گادولینیوم اجباری است. در صورت منع مصرف MRI یا CT برش نازک از مغز انجام می گردد. درمان جراحی ترانس اسفنوئیدال برای کاهش حجم توده ، رادیوتراپی و دارودرمانیبیشتر پرولاکتینومها با کابرگولین و بروموکریپتین (بیماران باردار) است. جراحی در آدنومهای تولید بیش از حد آدرنوکورتیکوتروپین مؤثر، اما در موارد غیر قابل تحمل، کتوکونازول، متیراپون و میفپریستون کاهش دهنده علائم هستند. اکترئوتید و لانروتید برای مهار هورمونهای رشد استفاده و در آکرومگالی، پگوویزومانت مفید است.
مقدمه:
آدنوماهای هیپوفیزی تودههای رشدیافتهای از سلولهای مونوکلونال با علائم تولید بیش از حد هورمونی، با یا بدون پرزانتاسیون عصبی هستند. پرولاکتینوماها، آدنوماهای غیرعملکردی هیپوفیز، آدنوماهای تولیدکنندهی هورمون رشد، آدنوماهای تولیدکنندهی هورمون آدرنوکورتیکوتروپین، آدنوماهای مولد هورمون تحریککنندهی تیرویید، آدنوماهای تولیدکنندهی گنادوتروپین و اینسیدنتالوماها نمونههایی از تومورهای هیپوفیزیاند. آدنوماهای هیپوفیزی براساس سایز به دستهی میکروآدنوم با سایز کمتر از یک میلیمتر و ماکرو آدنوم تقسیم میشوند. تومورهای عملکردی نیازمند مداخله سریع جهت جلوگیری از مورتالیتی و موربیدیتیهای مرتبط هستند (1, 2).
اپیدمیولوژی:
تخمین شیوع کلی آدنوماهای هیپوفیزی ۱۶. ۷ درصد در نظر گرفته شدهاست و بروز روند افزایشی دارد. آدنوماهای عملکردی در زنان بیشتر تشخیص داده میشوند. ۶۰ درصد انواع آدنوماهاو دارای عملکرد هستند و در این بین آدنوماهای مولد پرولاکتین جزء متداولترین آدنوماهای عملکردی است که زودتر از سایر زیرگروههای عملکردی تشخیص داده شده و اغلب زیر ۳ میلیمتر اندازه دارند. مورتالیتی در انواع علامت دار مهاجم و کارسینوماتوز بیشتر است (3).
پاتوژنز:
بیان بسیار در فاکتورهای ترجمهای، آسیب به تنظیمگر سیکل سلولی و رگولاتورهای اپی ژنتیکی میتوانند مکانیسم درگیر در ایجاد آدنوماهای هیپوفیزی را توضیح (4). تومورهای منشا رده سلولی Pit-1 , مسوول تولید بیش از حد هورمون ادرنوکورتیکوتروپین اند. تومور های منشا رده سلولی TPIT ,با رشد خوشخیم و تولید بیش از حد هورمون رشد, پرولاکتین وTSH همراه اند. بیان بیش از حد SF-1 با افزایش تولید گنادوتروپین ها همراهی دارند (5).
اپروچ به بیمار با تومور هیپوفیزی عملکردی:
بیماری کوشینگ در ترشح بیش از حد آدرنوکورتیکوتروپین، پرکاری تیروئید، آکرومگالی یا ژیگانتیسم و هیپر پرولاکتینوما یک تظاهرات بالینی مبتنی بر هورمونهای دخیل در تومورهای عملکردی هیپوفیز است. عملکرد بیش از حد گنادوتروپین ممکن است با علائم اثر تودهای، هیپوفیز یا حتی بدون علامت ظاهر شود. تشخیص بر اساس علائم بالینی است. اگر نشانهای از ترشح بیش از حد هورمون هیپوفیز وجود داشته باشد، آدنوم باید خارج شود. اگرچه ۳۰ درصد از آدنومها با کم کاری ظاهر میشوند. پانل هورمونی شامل پرولاکتین سرم، فاکتور رشد شبه انسولین 1 (1IGF-)، تست عملکرد تیروئید، همورمون لوتئینیزهکننده، هورمون تحریک فولیکولی، ارزیابی کورتیزول با آزمایش کورتیزول ۲۴ ساعته ادرار (UFC)، کورتیزول بزاق اواخر شب و سرکوب دگزامتازون است. اگر پرولاکتین سرم بیش از ۲۵۰ میکروگرم در لیتر باشد، احتمالات دیگری مانند پرولاکتینوما، کم کاری تیروئید، اثرات فشاری آدنوم کمعملکرد، بارداری و نارسایی کلیوی باید در نظر گرفته شود. همه بیماران با یا بدون علائم بینایی، یا با درگیری عصب بینایی در تصویربرداری باید تحت ارزیابی کامل میدان بینایی قرار گیرند. درگیری عصب جمجمه و علائم عصبی، شک به توده جمجمه را ایجاد میکند و MRI با یا بدون کنتراست گادولینیوم اجباری است. در صورت منع مصرف MRI یا CT برش نازک از مغز یک انتخاب است. CT خود نمیتواند درگیری کیاسما بینایی را به تصویر بکشد (6-10) .
تودههای اتفاقی حتی بدون علائم عملکردی نیاز به ارزیابی کامل هورمونی دارد. به دلیل اثربخشی مدیریت و عوارض کمتر، کاوش بیشتر در توده اتفاقی سودمند است (11).
مدیریت بیماران:
رویکرد اصلی برای مدیریت شرایط، جراحی ترانس اسفنوئیدال، رادیوتراپی و دارودرمانی است. اکثر بیماران از نظر پزشکی قابل کنترل هستند و نیازی به جراحی ندارند. اهداف درمانیشامل نرمالکردن سطح هورمون، کاهش علائم و بهبود اندازه تومور و اثرات توده هستند.
جراحی ترانس اسفنوئیدال برای کاهش حجم توده به عنوان درمان کمکی و نجات ساختارهای ضروری استفاده میشود. این روش نتایج بهتری در آدنومهای عملکردی دارد اما خطراتی از جمله کم کاری پس از عمل، دیابت بیمزه و نشت مایع مغزی نخاعی دارد.
رادیوتراپی نتایج آهستهای دارد که در مراحل اولیه به درمان دارویی نیازاست، اما نتایج برای مدت طولانی باقی میماند.
مدیریت دارویی در بیماران علامت دار، ضایعه را بدون کم کاری بعدی کنترل میکند، اما باید برای مدت طولانی مورد استفاده قرار گیرد و عوارض جانبی نیز در آگونیستهای سوماتوتروپین و آگونیستهای دوپامینی وجود دارند. بیشتر پرولاکتینومها با کابرگولین و بروموکریپتین (با عوارض جانبی عمده تهوع، استفراغ و ضعف) بهتر درمان میشوند. بروموکریپتین انتخابی برای بیماران باردار است. جراحی در آدنومهای تولید بیش از حد آدرنوکورتیکوتروپین مؤثرتر است، اما در موارد غیر قابل تحمل، کتوکونازول، متیراپون و میفپریستون کاهش دهنده علائم هستند. اکترئوتید و لانروتید برای مهار هورمونهای رشد استفاده میشوند. در آکرومگالی، پگوویزومانت مفید است(12-16).
منابع:
1. Aflorei ED, Korbonits M. Epidemiology and etiopathogenesis of pituitary adenomas. Journal of neuro-oncology. 2014;117(3):379-94.
2. Jasim S, Alahdab F, Ahmed AT, Tamhane S, Prokop LJ, Nippoldt TB, et al. Mortality in adults with hypopituitarism: a systematic review and meta-analysis. Endocrine. 2017;56(1):33-42.
3. Melmed S, Kaiser UB, Lopes MB, Bertherat J, Syro LV, Raverot G, et al. Clinical Biology of the Pituitary Adenoma. Endocrine reviews. 2022;43(6):1003-37.
4. Minematsu T, Miyai S, Kajiya H, Suzuki M, Sanno N, Takekoshi S, et al. Recent progress in studies of pituitary tumor pathogenesis. Endocrine. 2005;28(1):37-41.
5. Larkin S AO. Pathology And Pathogenesis Of Pituitary Adenomas And Other Sellar Lesions.
6. Arafah BM, Prunty D, Ybarra J, Hlavin ML, Selman WR. The Dominant Role of Increased Intrasellar Pressure in the Pathogenesis of Hypopituitarism, Hyperprolactinemia, and Headaches in Patients with Pituitary Adenomas*. The Journal of Clinical Endocrinology & Metabolism. 2000;85(5):1789-93.
7. Vance ML. Diagnosis, Management, and Prognosis of Pituitary Tumors. In: Thapar K, Kovacs K, Scheithauer BW, Lloyd RV, editors. Diagnosis and Management of Pituitary Tumors. Totowa, NJ: Humana Press; 2001. p. 165-72.
8. Nieman LK, Biller BMK, Findling JW, Newell-Price J, Savage MO, Stewart PM, et al. The Diagnosis of Cushing's Syndrome: An Endocrine Society Clinical Practice Guideline. The Journal of Clinical Endocrinology & Metabolism. 2008;93(5):1526-40.
9. Melmed S. Medical progress: Acromegaly. The New England journal of medicine. 2006;355(24):2558-73.
10. Melgar V, Espinosa E, Sosa E, Rangel MJ, Cuenca D, Ramírez C, et al. [Current diagnosis and treatment of hyperprolactinemia]. Revista medica del Instituto Mexicano del Seguro Social. 2016;54(1):111-21.
11. Freda PU, Beckers AM, Katznelson L, Molitch ME, Montori VM, Post KD, et al. Pituitary incidentaloma: an endocrine society clinical practice guideline. The Journal of clinical endocrinology and metabolism. 2011;96(4):894-904.
12. Melmed S. Pituitary-Tumor Endocrinopathies. The New England journal of medicine. 2020;382(10):937-50.
13. Lake MG, Krook LS, Cruz SV. Pituitary adenomas: an overview. American family physician. 2013;88(5):319-27.
14. Wang WF, Yang LH, Han L, Li MJ, Xiao JQ. Efficacy of transsphenoidal surgery for pituitary tumor: A protocol for systematic review. Medicine. 2019;98(6):e14434.
15. Owen TJ, Martin LG, Chen AV. Transsphenoidal Surgery for Pituitary Tumors and Other Sellar Masses. The Veterinary clinics of North America Small animal practice. 2018;48(1):129-51.
16. Varlamov EV, McCartney S, Fleseriu M. Functioning Pituitary Adenomas - Current Treatment Options and Emerging Medical Therapies. European endocrinology. 2019;15(1):30-40.
مقالات مرتبط
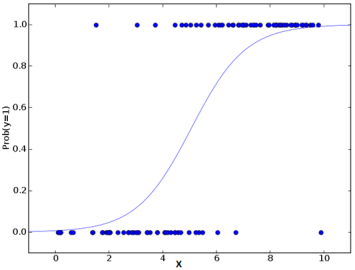
رگرسیون لجستیک (Logistic Regression)
یک روش آماری است که برای مدل سازی رابطه بین یک متغیر وابسته و یک یا چند متغیر مستقل استفاده می شود. در درجه اول برای حل مسائل طبقه بندی باینری استفاده می شود
تومورهای فورامن ژوگولار Jugular foramen tumors
فورمان ژوگولار حاوی عناصر مختلفی از جمله اعصاب مغزی زوج ۹و۱۰ و ۱۱ است که غلاف اطراف آن ها، توسط سلول های شوان تشکیل شده است، گاهی این غلاف تومورال میشود و شوانوم ایجاد میکند.