آدنوم هیپوفیزی غیرعملکردی
خلاصه مقاله
آدنوم های هیپوفیزی غیرعملکردی، تومورهای خوش خیم سلول های آدنوهیپوفیز هستند که در این نوع از تومور های هیپوفیزی افزایش ترشح هورمون های هیپوفیز رخ نداده و تظاهرات بالینی چشمگیری نیز وجود ندارد .تومور های غیر عملکردی هیپوفیز را می توان به 8 زیرگروه طبقه بندی کرد: لاکتوتروف، سوماتوتروف، تیروتروف، کورتیکوتروف، گنادوتروف خاموش، چند هورمونی، NFPA های دو/ سه گانه، نول سل و پیت -1 تظاهرات بالینی شایع در آدنوم های هیوفیزی :سردرد؛ اختلال در بینایی ، آپوپلکسی هیپوفیز؛ کمبودهای هورمونی می باشند از اختلالات هورمونی ایجاد شده:1- هیپوگنادیسم 2- هیپرپرولاکتینمی (معمولاً کمتر از mIU/L 2000 یا کمتر از 95 نانوگرم در میلیلیتر) می توان نام برد. بهترین روش تشخیصی در موارد مشکوک به آدنوم های هیپوفیزی Sellar MRI با گادولینیوم می باشد . همه بیماران، از جمله بیماران بدون شکایت بالینی، می بایست تست های آزمایشگاهی، بالینی و هورمونی را برای بررسی کاهش یا افزایش عملکرد هیپوفیز انجام دهند . برداشتن کامل تومور با جراحی، روش اصلی درمانی برای افرادی است که از علائم آدنوم های غیر عملکردی هیپوفیز رنج می برند. در موارد اختلال بینایی برداشتن کامل توده به واسطه جراحی و در آپوپلکسی با علائم عصبی-چشمی می بایست جراحی اورژانسی انجام می شود. رادیو تراپی یا پرتودرمانی درمان کمکی موثر در کنار جراحی به ویژه در تومورهای مقاوم یا عود کننده به کار برده می شود . یکی از مهم ترین موارد اندیکاسیون درمان های دارویی نام برده، در بیماران با تکه های باقی مانده از تومور در حفره سلار پس از جراحی ترانس اسفنوئیدال میباشد. مهم ترین داروهایی که تاثیرات آنها در آدنوم های هیپوفیز غیرعملکردی ارزیابی شده اند، عبارتند از: 1- آگونیست های دوپامین 2- آنالوگ های سوماتوستاتین 3- تموزولوماید
مقدمه
آدنوم های هیپوفیزی غیرعملکردی، تومورهای خوش خیم سلول های آدنوهیپوفیز هستند که در این نوع از تومور های هیپوفیزی افزایش ترشح هورمون های هیپوفیز رخ نداده و تظاهرات بالینی چشمگیری نیز وجود ندارد (1). بر اساس آخرین طبقه بندی سازمان بهداشت جهانی (WHO، ژنو، سوئیس) که در سال 2022 تجدید نظر شد، اصطلاح آدنوم هیپوفیز به تومور نورواندوکرین هیپوفیز تغییر نام داد (2). سازمان جهانی بهداشت (WHO) در ویرایش چهارم طبقه بندی تومورهای غدد درون ریز، تومور های غیر عملکردی هیپوفیز را به 8 زیرگروه طبقه بندی کرد، از جمله:، لاکتوتروف، سوماتوتروف، تیروتروف، کورتیکوتروف، گنادوتروف خاموش، چند هورمونی، NFPA های دو/ سه گانه، نول سل و پیت -1 (3). همچنین به دلیل عدم وجود علائم و شکایات بالینی، بر خلاف بیان ایمونوهیستوشیمیایی ژن های دخیل در تولید هورمون های هیپوفیز قدامی، این نوع تومورها را آدنوم خاموش نیز می نامند (4). متاستاز و تغییرات بدخیمی در آدنوم هیپوفیز غیرعملکردی بسیار نادر است که در صورت وقوع این امر از طریق انتشار سیستمیک یا کرانیواسپاینال رخ می دهد (5).
اپیدمیولوژی
اطلاعات جمع آوری شده از اروپا، آمریکای شمالی و جنوبی شیوع 41.3-7 نفر در هر 100000 جمعیت را گزارش کردند (6). هر چند که نتایج این مطالعه به طور قطع قابل اعتماد نیست زیرا بسیاری از تومور های غیر عملکردی هیپوفیز تا زمانی که به اندازه کافی بزرگ شوند و به واسطه اثر گذاری بر مجاورات آناتومیک خود علائمی را ایجاد کنند، شناسایی نمی شوند؛ مگر اینکه به طور تصادفی تشخیص داده شوند. (1). در مطالعه ای دیگر که در کره جنوبی انجام شد نشان داده شد که بروز تومور غیرعملکردی هیپوفیزی3.5 مورد در هر 100000 جمعیت است که به طور قابل توجهی بیشتر از موارد سالانه گزارش شده در کشورهای دیگر مانند آرژانتین، فنلاند و سوئد می باشد که این تفاوت می تواند به دلیل تفاوت بین مطالعات انجام شده باشد یا تحت تاثیر عوامل دیگری نظیر فاکتور های محیطی و ژنتیکی در جمعیت های آسیایی همچنین تفاوت در دسترسی به امکانات تشخیصی نظیر CT-scan یا MRI باشد (1).
تظاهرات بالینی :
در آدنوم های هیپوفیزی غیرعملکردی به دلیل عدم ترشح بیش از هرومون ها و فقدان علائم مربوط به افزایش ترشح هورمون ها اغلب تاخیر قابل توجهی در تشخیص ایجاد می شود، بنابراین آدنوم های هیپوفیز غیرعملکردی ممکن است تا زمانی که اثرات فضایی ناشی از رشد تومور بر ساختارهای مجاور ظاهر نشوند، بی علامت باشند و از تشخیص بازبمانند (7).
با در نظر گرفتن همه موارد فوق تظاهرات بالینی شایع در آدنوم های هیوفیزی عبارتند از :
سردرد؛ به دلیل فعال شدن مسیرهای درد تری ژمینال، کشش گیرنده های درد در غشای دورال و افزایش فشار حغره سلاتورسیکا (6, 9)
اختلال در بینایی؛ به واسطه فشار وارد برکیاسمای بینایی (10)
آپوپلکسی هیپوفیز؛ خونریزی ناگهانی در آدنوم هیپوفیز (8)
کمبودهای هورمونی؛ وقوع کمبود حداقل یک نوع هورمون هیپوفیزی به دنبال فشرده شدن هیپوفیز قدامی و نهایتا کاهش ترشح هورمون یا فشار بر ساقه هیپوفیز و انسداد آن که به عنوان پل ارتباطی برای عبور فاکتور های تحریکی هیپوتالاموس بر ترشح هورمون های هیپوفیزی می باشد11) ).
دو مورد از مهم ترین اختلالات هورمونی ایجاد شده در تومور های غیرعملکردی هیپوفیز عبارتند از:
1- هیپوگنادیسم در نتیجه اثر فشاری روی سلولهای گنادوتروپ
2- هیپرپرولاکتینمی (معمولاً کمتر از mIU/L 2000 یا کمتر از 95 نانوگرم در میلیلیتر) که در اثر فشردهسازی ساقه هیپوفیز و ممانعت از رسیدن دوپامین به عنوان یک فاکتور مهارکننده ترشح پرولاکتین در هیپوفیز قدامی، رخ دهد ( 12-14).
تشخیص:
بهترین روش تشخیصی در موارد مشکوک به آدنوم های هیپوفیزی Sellar MRI با گادولینیوم می باشد چرا که تصاویری با وضوح بسیار بالا از توده و ارتباط آن با ساختارهای اطراف ارائه می دهد. آدنوم های غیرعملکردی هیپوفیز در تصاویر T1 در MRI معمولاً به صورت ایزو اینتنس یا هیپواینتنس نسبت به بافت طبیعی هیپوفیز، به نظر می رسند همچنین توجه به این نکته ضروری است که در آدنوم های هیوفیزی نسبت به بافت طبیعی هیپوفیز، جذب ماده حاجب دیر تر صورت گرفته بنابراین انتظار می رود که این توده ها با تصاویر کنتراست تاخیری همراه باشند .(15) علاوه بر این موارد، بر اساس آخرین دستورالعمل های ارائه شده برای یافتن توده های سلار، همه بیماران، از جمله بیماران بدون شکایت بالینی، می بایست تست های آزمایشگاهی، بالینی و هورمونی را برای بررسی کاهش یا افزایش عملکرد هیپوفیز انجام دهند .(16)
درمان:
برداشتن کامل تومور با جراحی، روش اصلی درمانی برای افرادی است که از علائم آدنوم های غیر عملکردی هیپوفیز رنج می برند (17) برای مثال در موارد بروز شکایات عصبی و چشمی؛ یا در موارد اختلال بینایی به دلیل فشار تومور بر کیاسم بینایی برداشتن کامل توده به واسطه جراحی اندیکاسیون دارد همچنین در موارد آپوپلکسی که با علائم عصبی-چشمی همراه است می بایست جراحی اورژانسی انجام می شود. برخی از جراحان مغز و اعصاب بر این باورند که همه آدنوم های بزرگتر از 2 سانتی متر به دلیل امکان رشد بیشتر باید تحت عمل جراحی قرار گیرند 18)).
رادیو تراپی یا پرتودرمانی روشی است که به عنوان یک درمان کمکی موثر در کنار جراحی به ویژه در تومورهای مقاوم یا عود کننده به کار برده می شود با این حال، ممکن است استفاده طولانی مدت از رادیوتراپی با خطر هیپوپوتیتاریسم یا کم کاری هیپوفیز همراه باشد . (17,19,20) تکنیک های استریوتاکتیک، از جمله رادیوتراپی استریوتاکتیک قطعه ای یا رادیوسرجری استریوتاکتیکال با هدف تابش محدودتر و کاهش عوارض جانبی و در نهایت کنترل بهتر آدنوم های غیرعملکردی هیپوفیزامروزه به کاربرده می شوند .(21)
مهم ترین داروهایی که تاثیرات آنها در آدنوم های هیپوفیز غیرعملکردی ارزیابی شده اند، عبارتند از
1- آگونیست های دوپامین (22, 23) (DA)
2- آنالوگ های سوماتوستاتین (24, 25) (SAs)
3- تموزولوماید (26) (TMZ)
همچنین توجه با این نکته کلیدی ضروری است که یکی از مهم ترین موارد اندیکاسیون درمان های دارویی نام برده، در بیماران با تکه های باقی مانده از تومور در حفره سلار پس از جراحی ترانس اسفنوئیدال میباشد.(1)
REFERENCES:
1. Drummond JB, Ribeiro-Oliveira A, Jr., Soares BS. Non-Functioning Pituitary Adenomas. In: Feingold KR, Anawalt B, Blackman MR, Boyce A, Chrousos G, Corpas E, et al., editors. Endotext. South Dartmouth (MA): MDText.com, Inc.
Copyright © 2000-2023, MDText.com, Inc.; 2000.
2. Asa SL, Mete O, Perry A, Osamura RY. Overview of the 2022 WHO Classification of Pituitary Tumors. Endocr Pathol. 2022;33(1):6-26.
3. Esposito D, Olsson DS, Ragnarsson O, Buchfelder M, Skoglund T, Johannsson G. Non-functioning pituitary adenomas: indications for pituitary surgery and post-surgical management. Pituitary. 2019;22(4):422-34.
4. WHO classification of tumours of endocrine organs [Internet]. International Agency for Research on Cancer (IARC). 2017.
5. Lenders N, McCormack A. Malignant transformation in non-functioning pituitary adenomas (pituitary carcinoma). Pituitary. 2018;21(2):217-29.
6. Ntali G, Wass JA. Epidemiology, clinical presentation and diagnosis of non-functioning pituitary adenomas. Pituitary. 2018;21(2):111-8.
7. Fleseriu M, Karavitaki N. Non-functioning pituitary adenomas, not all the same and certainly not boring! Pituitary. 2018;21(2):109-10.
8. Vargas G, Gonzalez B, Ramirez C, Ferreira A, Espinosa E, Mendoza V, et al. Clinical characteristics and treatment outcome of 485 patients with nonfunctioning pituitary macroadenomas. Int J Endocrinol. 2015;2015:756069.
9. Greenman Y, Melmed S. Diagnosis and management of nonfunctioning pituitary tumors. Annu Rev Med. 1996;47:95-106.
10. Ferrante E, Ferraroni M, Castrignanò T, Menicatti L, Anagni M, Reimondo G, et al. Non-functioning pituitary adenoma database: a useful resource to improve the clinical management of pituitary tumors. Eur J Endocrinol. 2006;155(6):823-9.
11. Sonigo C, Bouilly J, Carré N, Tolle V, Caraty A, Tello J, et al. Hyperprolactinemia-induced ovarian acyclicity is reversed by kisspeptin administration. J Clin Invest. 2012;122(10):3791-5.
12. Karavitaki N, Thanabalasingham G, Shore HC, Trifanescu R, Ansorge O, Meston N, et al. Do the limits of serum prolactin in disconnection hyperprolactinaemia need re-definition? A study of 226 patients with histologically verified non-functioning pituitary macroadenoma. Clin Endocrinol (Oxf). 2006;65(4):524-9.
13. Freda PU, Bruce JN, Khandji AG, Jin Z, Hickman RA, Frey E, et al. Presenting Features in 269 Patients With Clinically Nonfunctioning Pituitary Adenomas Enrolled in a Prospective Study. J Endocr Soc. 2020;4(4):bvaa021.
14. Kim JH, Dho YS, Kim YH, Lee JH, Lee JH, Hong AR, et al. Developing an optimal follow-up strategy based on the natural history of nonfunctioning pituitary adenomas. J Neurosurg. 2018;131(2):500-6.
15. Raverot G, Assié G, Cotton F, Cogne M, Boulin A, Dherbomez M, et al., editors. Biological and radiological exploration and management of non-functioning pituitary adenoma. Annales d'endocrinologie; 2015: Elsevier.
16. Freda PU, Beckers AM, Katznelson L, Molitch ME, Montori VM, Post KD, et al. Pituitary incidentaloma: an endocrine society clinical practice guideline. J Clin Endocrinol Metab. 2011;96(4):894-904.
17. Lucas JW, Bodach ME, Tumialan LM, Oyesiku NM, Patil CG, Litvack Z, et al. Congress of Neurological Surgeons Systematic Review and Evidence-Based Guideline on Primary Management of Patients With Nonfunctioning Pituitary Adenomas. Neurosurgery. 2016;79(4):E533-5.
18. Huang W, Molitch ME. Management of nonfunctioning pituitary adenomas (NFAs): observation. Pituitary. 2018;21(2):162-7.
19. Brochier S, Galland F, Kujas M, Parker F, Gaillard S, Raftopoulos C, et al. Factors predicting relapse of nonfunctioning pituitary macroadenomas after neurosurgery: a study of 142 patients. Eur J Endocrinol. 2010;163(2):193-200.
20. Colao A, Cerbone G, Cappabianca P, Ferone D, Alfieri A, Di Salle F, et al. Effect of surgery and radiotherapy on visual and endocrine function in nonfunctioning pituitary adenomas. J Endocrinol Invest. 1998;21(5):284-90.
21. Minniti G, Clarke E, Scaringi C, Enrici RM. Stereotactic radiotherapy and radiosurgery for non-functioning and secreting pituitary adenomas. Rep Pract Oncol Radiother. 2016;21(4):370-8.
22. Nobels FR, de Herder WW, van den Brink WM, Kwekkeboom DJ, Hofland LJ, Zuyderwijk J, et al. Long-term treatment with the dopamine agonist quinagolide of patients with clinically non-functioning pituitary adenoma. Eur J Endocrinol. 2000;143(5):615-21.
23. Garcia EC, Naves LA, Silva AO, de Castro LF, Casulari LA, Azevedo MF. Short-term treatment with cabergoline can lead to tumor shrinkage in patients with nonfunctioning pituitary adenomas. Pituitary. 2013;16(2):189-94.
24. Taboada GF, Luque RM, Bastos W, Guimarães RF, Marcondes JB, Chimelli LM, et al. Quantitative analysis of somatostatin receptor subtype (SSTR1-5) gene expression levels in somatotropinomas and non-functioning pituitary adenomas. Eur J Endocrinol. 2007;156(1):65-74.
25. Lee M, Lupp A, Mendoza N, Martin N, Beschorner R, Honegger J, et al. SSTR3 is a putative target for the medical treatment of gonadotroph adenomas of the pituitary. Endocr Relat Cancer. 2015;22(1):111-9.
26. McCormack A, Dekkers OM, Petersenn S, Popovic V, Trouillas J, Raverot G, et al. Treatment of aggressive pituitary tumours and carcinomas: results of a European Society of Endocrinology (ESE) survey 2016. Eur J Endocrinol. 2018;178(3):265-76.
مقالات مرتبط
والتر ادوارد دندی
والتر ای. دندی در سال 1886 در سدالیا، میسوری به دنیا آمد. دکتر دندی در رتبه دوم در بین فارغ التحصیلان دانشکده پزشکی قرار گرفت.
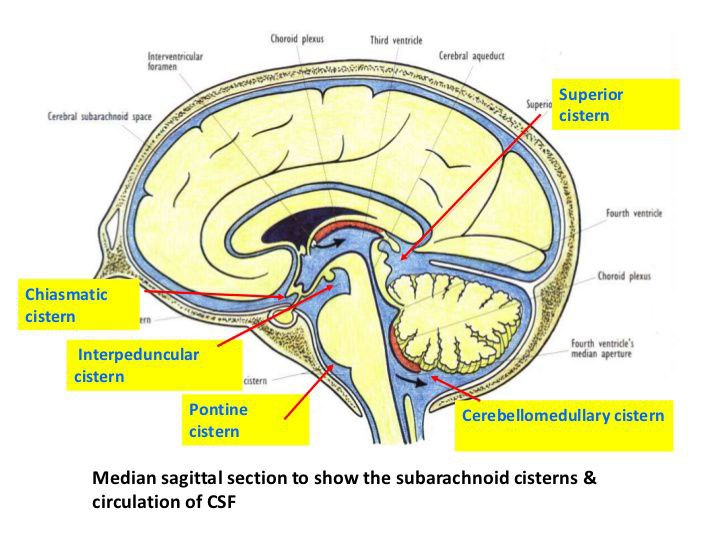
مخزن کیاسماتیک
مخزن کیاسماتیک، یک ساختار بدون جفت است که اعصاب بینایی و کیاسم را در بر می گیرد، و در بالا توسط مخزن lamina terminalis، از جانبی توسط مخزن کاروتید، و در خلف توسط مخزن بین ساقه ای مرزبندی شده است. Cisterna chiasmatica که به دلیل موقعیت برترش نسبت به sella turcica به عنوان مخزن سوپراسلار نیز شناخته میشود، ساختاری در خط وسط است که بین قسمتهای لوب تمپورال و زیر هیپوتالاموس قرار دارد